刘 昱1 ,周子丹2 ,伍 洋3 ,张蓬朝1 ,田雨丰2 ,李光强1
(1. 武汉科技大学 钢铁冶金及资源利用省部共建教育部重点实验室,湖北 武汉 430081;
2. 武汉科技大学 钢铁冶金新工艺湖北省重点实验室,湖北 武汉 430081;
3.湖北城市建设职业技术学院,湖北 武汉 430200)
摘 要:综述了转炉钢渣的两种直接碳化方式及其影响因素和动力学机制,钢渣的高温碳化主要限制性环节是 CO2穿过产物层向钢渣内部未反应区域的扩散,通过提高温度加快 CO2 的扩散速率和降低钢渣颗粒尺寸以减小抑制扩散的产物层厚度等措施,可大幅提高钢渣高温碳化的固碳量和转化率。湿法碳化的主要限制环节是钢渣中钙从内部向钢渣表面的扩散,降低钢渣颗粒尺寸和利用超声波震荡破坏产物层能有效加快钙扩散浸出。由于钢渣从转炉出来后具有较高的温度,且单一的碳化方式都有其局限,可考虑将两种固碳方式结合使用,首先在高温钢渣的冷却过程中利用钢渣余热进行高温干法碳化,并降低钢渣颗粒尺寸和增加 CO2压力来提高固碳量和钙的转化率;通过干法碳化固定一部分钙,而后再进行湿法碳化,这样有利于缩短湿法碳化时间,待钢渣高温碳化结束经冷却球磨后再进行湿法碳化,结合尺寸优化和超声波的利用,实现钢渣最大程度的碳化;该过程充分利用了钢渣自身条件,能更有效实现固碳过程的节能减排。
关键词:转炉钢渣;高温干法碳化;湿法碳化;动力学;扩散
大量化石燃料消耗所产生的 CO2是造成温室效应和全球气候变暖的主要原因,从工业革命开始,空气中 CO2的体积分数已经从 280´10-6 增加到 415´10-6,并且还在增加[1]。与此同时,自 1880 年以来全球气温已经上升约 1.05 ℃,这是世界面临的最严重的环境危害[2]。为了避免全球变暖和气候变化可能造成的破坏性后果,必须大大减少人为活动造成的CO2 排放。然而,化石燃料的便捷性及相对实惠的市场价值使得其他的能量来源暂时很难将其替代。通过吸收产生的 CO2减少其排放,即碳的捕捉与存储技术,是十分有前景的解决途径[3-4]。最早的固碳方法是通过地质封存,在 20 世纪 70 年代的采掘工业中得到了大规模应用,以提高油气采收率;虽然这种类型的储存可能有足够的容量,但存在泄漏风险和储存 CO2的长期管理问题[5]。也有报道提出将 CO2注入海洋,与水反应形成碳酸,达到海洋固碳的目的,然而,这种方案对环境的影响具有不确定性,特别是会导致海水 pH 值降低且缺乏持久性[4]。
最具前景和可行性的碳捕捉与存储的技术方案是由 Seifritz 在 1990 年首次提出的通过矿物碳化的方式吸收 CO2 [6],并由 Lackner 等人首先进行了更为细致的研究[7]。矿物碳化吸收 CO2的基本原理是模拟自然风化过程,通过利用含钙或镁的矿物吸收 CO2形成碳酸钙或碳酸镁来固定 CO2,如式(1)所示:
(Ca,Mg)SiO3(s)+CO2(g)→(Ca,Mg)CO3(s)+SiO2(s) (1)
相比上述两种 CO2封存方式,矿物碳化吸收 CO2具有以下潜在优势:其一是矿物碳化是一种化学固碳方式,产物具有热力学稳定性,CO2 存储是永久性的且本质上安全可靠;此外,由于碳化反应是放热反应,固碳过程能源消耗有限。劣势是需要消耗大量的钙/镁矿石,但是大量的含钙/镁的工业固废可以替代矿石用于 CO2的固定,如钢渣、飞灰等。这些工艺副产品一般是碱性的且富含钙,与矿石固碳相比具有更低的成本,将其用于固碳也能起到固废处理及其二次利用的作用。
目前国内多采用氧气转炉炼钢工艺,每吨钢产生100~130 kg的钢渣。由于需要满足钢水脱磷的要求,转炉钢渣含有较高的 CaO含量,使得钢渣中含有自由氧化钙,在水化时会导致体积膨胀,这给转炉钢渣的再利用带来困难,大量钢渣的堆放占用空间,造成土地资源的浪费,产生的粉尘也会加大工程环保压力、危害人员健康。现有转炉钢渣处理工艺由于处理成本高、性能多变而导致钢渣应用程度有限。相比之下,通过对转炉钢渣进行碳化处理,使钢渣中的碱性氧化物与 CO2反应形成碳酸盐,不仅可以消除钢渣中的自由氧化钙,而且钢铁工业也是 CO2排放大户,钢渣固碳可以就近利用 CO2,减少碳排放,碳化处理后的钢渣可用于混凝土等基础设施建设材料[7-9]。
自然风化过程太慢,因此,以矿物碳化方式实现 CO2封存的研究目的是加速反应,以获得可行的工业过程。目前关于矿物的碳化主要有两种方式:直接碳化和间接碳化。如图1 所示[10],直接碳化是最简单的矿物固碳方式,其原理是利用干燥、潮湿或含水的环境,在单一反应步骤中实现碳酸化;而间接碳化分几个步骤实现,包括碱性元素的浸出提取和碳酸化。
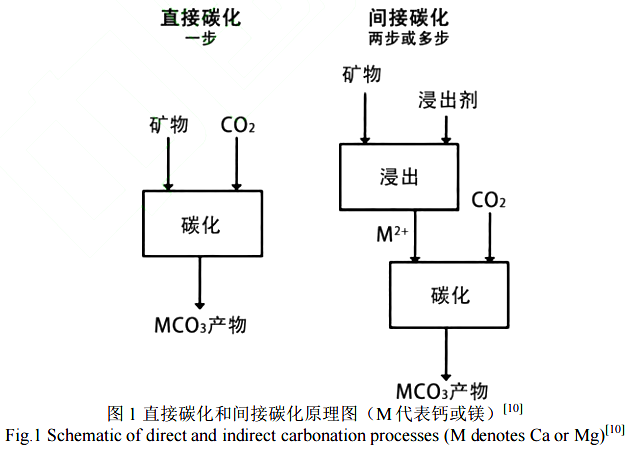
关于利用 CH3COOH 或铵盐对钢渣进行间接碳化的研究有很多[11-13],从这些研究工作中可以看出一个普遍趋势是,虽然通过这些方法可以利用废弃物生产出有价值的产品(较高纯度的碳酸钙),但也会带来其他问题,包括含有不稳定重金属的残余固废,以及含盐和重金属的废水,废物处理的目标并没有完全实现。
相比之下,直接碳化不需要使用浸出溶剂,具备成本优势[14]。转炉钢渣的处理主要采用直接碳化的方式进行,可分为干法碳化和湿法碳化两类[15]。本文将结合文献从热力学和动力学角度总结归纳钢渣碳化的影响因素及相关作用机制,为加快钢渣碳化、实现钢渣再利用及减少碳排放提供理论指导。
1 转炉钢渣碳化的热力学与动力学
转炉钢渣中含钙矿物如 f-CaO、C3S、β-C2S 及水化活性低的 γ-C2S 和硅酸盐(CaSiO3(CS))等均能发生碳化反应,这为钢渣碳化提供了良好的物质条件[16]。虽然钢渣的水化反应活性较低,但在富 CO2的环境下,钢渣中各种含钙矿物组分表现出较高的碳化反应活性。而在自然条件下,钢渣碳化缓慢,且过程比较复杂。转炉钢渣碳化主要采用直接碳化,该方法可分为两类:干法碳化和湿法碳化。
干法碳化是一个气-固反应过程,气态 CO2直接与渣中碱金属氧化物反应形成碳酸盐,如式(2)所示[10]:
CaO+CO2→CaCO3 (2)
该反应属于放热反应,从钢渣成分来看,其在气-固反应固碳方面有着显著的优势。但气-固反应固碳的反应速率却相对较慢,导致较低的固碳量[17-19]。其反应动力学过程符合未反应核模型[20],在反应初期,其反应动力学过程主要为:1)CO2向气相/固相反应界面扩散;2)气相/固相界面处 CO2气体与钢渣中碱金属氧化物发生反应。此时,一般气体外扩散不是限制性环节,碳化反应速率主要由界面化学反应速率控制。而随着界面化学反应的发生,新相碳酸钙产物层的形成,反应过程包括以下环节:1)气体在钢渣颗粒外的外扩散;2)气体穿过固相产物层的内扩散;3)气体与固体物的界面化学反应。Revathy 等人[21]对室温下钢渣的干法碳化进行了研究,发现碳化过程可以在室温下自发进行,在 1 h 的碳化后钢渣的固碳速率减慢,3 h 后 CO2吸收量几乎不再增加,这主要是由于钢渣颗粒表面在碳化过程中形成的碳酸盐层以及反应后残余的贫钙硅酸盐区域阻碍了 CO2气体向钢渣颗粒中心未反应区的扩散。在气-固反应固碳过程中反应初始固碳速率快,受到化学反应速率控制;而后随着新相产物层的形成、长大,产物层逐渐包裹中心未反应区,反应开始受到扩散传质控制,固碳速率开始变得缓慢,这也导致干法固碳的固碳量有限[17,20]。由于温度对于加快反应速率有着重要作用,通过提高碳化温度可以起到加快初期碳化速率的效果,因此在高温下钢渣干法固碳更为有利[10,22]。
而湿法碳化过程以水为介质,碳化过程包含气-液-固三相,相比干法碳化的反应过程更加复杂。水的存在为 CO2气体的溶解和从钢渣中浸出钙离子提供了良好的条件,有助于提高碳化反应速率。此外,不需要像干法碳化一样的高温,有利于较长时间进行碳化反应[23-24]。湿法碳化反应过程如式(3)~式(5)所示[25]:
CO2+H2O→2H+ +CO3 2- (3)
CaSiO3+2H+ →Ca2++SiO2+H2O (4)
Ca2++CO3 2-→CaCO3 (5)
湿法碳化的第一步是 CO2溶入水溶液中,然后 CO2和水反应形成碳酸根和氢离子。氢离子从矿物中浸出金属钙离子,最后钙离子和碳酸根离子结合形成碳酸钙,完成钢渣的碳化过程,反应过程如图 2 所示。从图 2 可以看出,碳化反应发生后 CaCO3和 SiO2作为产物层在钢渣颗粒表面形成,反应过程动力学符合未反应核模型[14,18]。产物层形成后,随后的碳化反应过程如下:1)气体向液相中的溶解;2)离子穿过产物层的扩散;3)界面反应形成碳酸钙。这是湿法直接碳化反应的关键特征,也正是产物层的存在减缓了进一步的碳化反应速率[26]。
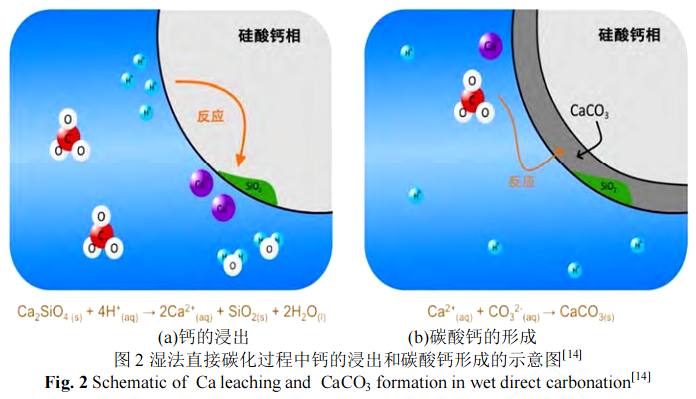
室温下干法碳化固碳量低且速率慢,不具备固碳优势,而高温下的干法碳化有利于提高 CO2的扩散速率,因此下文主要针对高温干法碳化和常规湿法碳化的影响因素展开论述。
2 转炉钢渣高温干法碳化的影响因素
高温下有利于加快扩散传质,因而也常用于二氧化碳的捕获和分离系统中,该系统利用石灰基吸收剂进行循环碳化/煅烧循环,通常在 600~700 ℃进行[27-29]。钢渣从转炉出来本身就自带高温(>500 ℃),这就为钢渣的高温干法碳化提供了很好的条件,其碳化处理过程示意图如图 3 所示[4]。
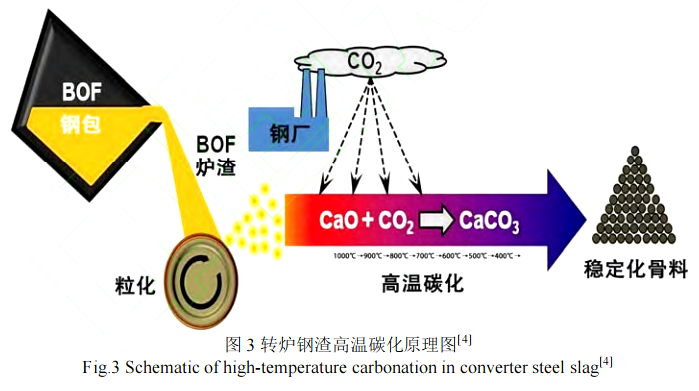
2.1 温度对干法固碳的影响
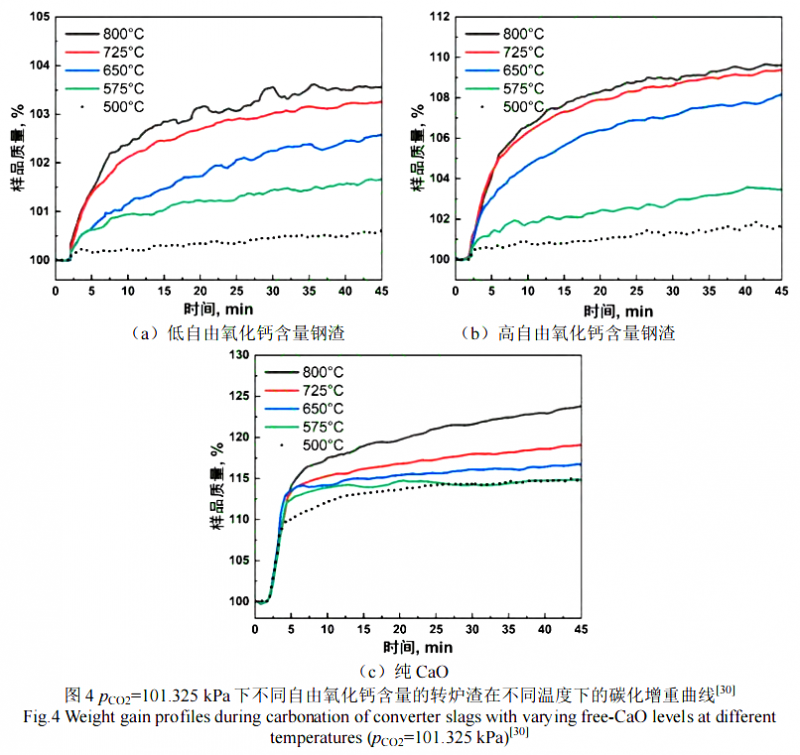
Santos 等人[30]针对转炉钢渣的高温碳化做了深入的探究,选取了 2 组转炉渣 BOFI(自由氧化钙含量低)、BOFII(自由氧化钙含量高)和纯 CaO,首先在 pCO2=101.325 kPa 的条件下通过 TGA 试验探索了碳化温度的临界值在 900 ℃左右,900 ℃以上碳化形成的碳酸钙会发生分解;分析了不同自由氧化钙含量和不同温度对转炉钢渣碳化增重的影响(如图4),发现更高自由氧化钙含量的钢渣固碳量更大且固碳速率也更快;在 500~800 ℃,提高温度,固碳量和固碳速率也会增加。纯 CaO 在碳化初期增重曲线呈线性增加,不同温度下曲线斜率相差不大,表明初期碳化速率随温度变化不大;随后反应性减弱,但温度越高碳化速率越快(图 4c)。相比之下,转炉渣由于表面和外孔的快速碳化,碳化刚开始时有着非常短暂的急剧增重(1 min 内),之后呈现出速率衰减型趋势,CO2 缓慢深入渗透到颗粒中进行反应,从而持续增重(图 4a,图 4b)。可以看出,温度对转炉渣碳化的影响比对纯CaO 的影响更大,由于纯 CaO 样品的表面有足够的 CaO 可用于碳化反应,初期碳化反应的进行不涉及到 CO2的扩散,而不同温度下纯 CaO 样品初期碳化的增重差异不大,说明碳化过程中温度对化学反应的影响不大,此时想要提高反应速率应该是加大 CO2 浓度或压力。结合转炉渣的增重曲线可知,从促进初期碳化反应速率来看,温度的提升可以很好加快前期碳化速率;从固碳量的角度来看,温度对控制 CO2 扩散比控制碳化反应对钢渣碳化过程的作用更大,对于钢渣而言,表面 CaO 少,碳化增重曲线短暂大幅上升后,表面 CaO消耗完,进一步碳化需要 CO2扩散至样品未反应区域内进行。纯 CaO 样品在碳化一段时间后,由于碳酸钙层的形成,CO2 的扩散也成为了限制性环节,反应速率逐渐降低。更高温度下,CO2 的扩散速率更快,因而碳化增重量也越大。此外,在加压加热的试验条件下,发现最佳碳化温度紧紧处于稳定碳化和碳酸盐分解之间的转变温度之下:在 pCO2=101.325kPa 时,最佳碳化温度在 830~850 ℃;在 pCO2=20.265 kPa 时,最佳碳化温度在 750~770 ℃,这是因为更高的 CO2 压力下,碳酸盐的稳定性增加。加压和通过蒸汽加湿 CO2 可以促进碳化,但是作用不大,因为扩散限制了样品中心未反应区自由氧化钙的转化。通过提高温度加快 CO2 的扩散速率是行之有效的措施,且钢铁生产企业烟气中自带高温 CO2(pCO2=20.265 kPa),不需要额外的加热分离或浓缩处理。
2.2 CO2浓度对干法固碳的影响
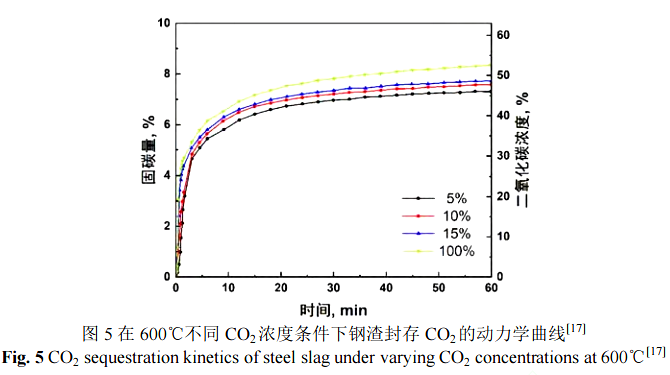
Tian 等人研究了在 600 ℃干法固碳过程中气氛 CO2浓度对固碳量的影响,固碳过程的动力学曲线如图 5 所示[17]。可以看出,在 1 h 内的碳化反应动力学曲线的变化趋势几乎是相似的。固碳量随着 CO2浓度的增加逐渐增加,但是增加的幅度不大。仅仅 CO2体积分数在 100%时固碳量与另外其他 3 组低浓度的试验有一定差距。当 CO2体积分数在 5%~100%时,最终的碳化转化率在 45.9%~52.5%内波动。这为钢渣干法封存炼钢厂高温烟气(CO2 体积分数在 5%~15%)中的 CO2提供了可能。相比温度对钢渣干法碳化的影响,CO2浓度的影响更小。
2.3 钢渣颗粒尺寸对干法固碳的影响
减小钢渣颗粒尺寸有助于提高钢渣颗粒比表面、缩短钢渣碳化过程的扩散距离,从而加快钢渣碳化。在工业上实现对钢渣的高温干法碳化前仍然需要进一步的优化,尽管高温下有着良好的碳化反应动力学和更快的 CO2扩散速率,但是自由氧化钙的完全转化仍然受到 CO2向钢渣颗粒内部扩散的影响,即使在钢渣颗粒尺寸为 0.08~0.5 mm 的试验中[30],尺寸仍然还需要进一步降低来缩短 CO2的扩散距离。其试验使用的钢渣尺寸已经是目前滚动造粒设备的最小尺寸,因此想要获得更低尺寸的钢渣颗粒以促进自由氧化钙转化,还有赖于造粒和热态球磨技术的进一步发展。尽管在工艺优化的条件下,钢渣在冷却过程中在高温段经历的时间毕竟有限,额外的提高钢渣的能源供应也会加大固碳成本且起不到节能减排目的,因而结合生产实际的高温干法碳化只是可以充分利用钢渣余热和高温的 CO2 烟气,并不能最大程度实现钢渣的固碳转化。
3 转炉钢渣湿法碳化的影响因素
温度、液固比、CO2压力、钢渣的粒径及超声波等对钢渣湿法碳化过程的固碳速率都有很重要的影响[25, 31-35]。
3.1 温度对湿法碳化的影响
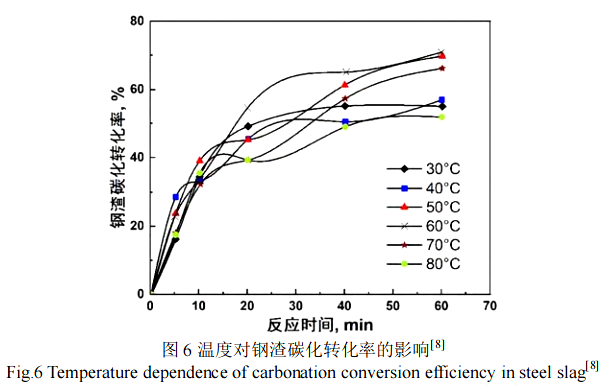
Chang 等人[8]在 30~80 ℃内研究了转炉钢渣在 1 h 内固碳转化率的变化,发现固碳转化率在 60 ℃时最大,转化率为 72.2%(如图 6 所示)。温度对固碳过程有着重要的影响,能同时影响化学反应速率和平衡常数、CO2 在水溶液中的溶解和钙离子的浸出过程。根据Arrhenius 公式,随着温度的增加,反应速率常数呈指数级增加,碳化反应速率被显著提高。温度的增加也可以加快钢渣颗粒中钙离子的浸出,但同时也会造成 CO2 在溶液中的溶解量降低。因此,温度对于固碳转化率的影响有着两面性。在 60 ℃以下,随着温度的增加,由于更高的钙离子浸出率,固碳转化率提高。而在 60 ℃以上时,随着温度的进一步增加,由于 CO2在溶液中的溶解量降低,导致固碳转化率下降;在 60~80 ℃,CO2在溶液中的溶解被认为是影响碳化过程的关键因素。
3.2 液固比对湿法碳化的影响
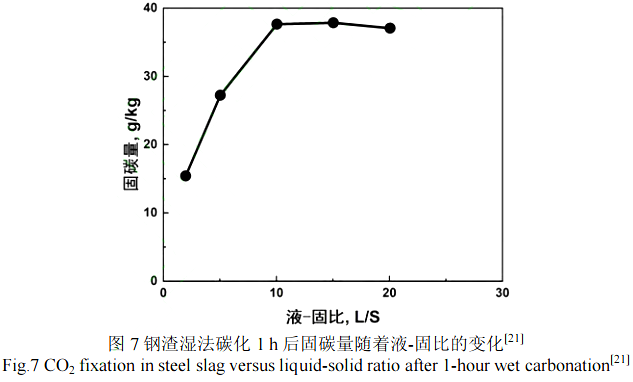
液固比是钢渣湿法碳化的关键参数之一,是指单位质量的钢渣所使用液体的体积(L/kg)。水的存在对湿法碳化过程中 CO2的溶解和其在水中的扩散以及钢渣中金属离子的浸出有着至关重要的影响[14]。Kurusta 等人[36]研究了水在钢渣碳化反应中的作用,发现相比干法碳化,湿法碳化的固碳量是干法的 3 倍。Revathy 等人[21]研究了液固比在 0~30 内对钢渣湿法碳化 1 h 后固碳量的影响,如图 7 所示。随着液-固比的增加,固碳量先增加,而后减小。低固液比条件下 CO2的溶解量有限,同时也不利于钙的浸出,但水含量过高会导致液体中溶解的 CO2的浓度和浸出的金属离子的浓度降低,同时也会阻碍气体分子在渣浆中的扩散,导致碳化速率和固碳量降低[23]。
3.3 CO2压力对湿法碳化的影响
CO2 压力对于其在溶液中的溶解度有很大影响,增加压力有助于提高溶液中 CO2 的溶解量。当 CO2 压力低于临界值时,钙的浸出和固碳量明显降低,主要是因为溶液中溶解的CO2 量不够。此时,CO2 的溶解是碳化反应的限制性环节时,增加 CO2 压力可以起到促进钢渣碳化的作用,已有研究表明增加 CO2 分压可以显著提高钢渣的碳化程度和固碳量。但当 CO2 压力超过临界值时,CO2 压力对碳化过程的影响不大,说明 CO2 的传质不是碳化反应的限制性环节。此时,钙离子的浸出成为碳化过程的限制性环节,CO2 压力的影响减弱[25,37-38]。过高的 CO2压力也会导致碳化矿相的快速析出长大,在钢渣表面形成碳化产物层,阻碍钢渣内部未反应区的进一步碳化[37]。吴昊泽等人[35]发现 CO2压力递增比在单一CO2压力下的碳化效果更好,因此在湿法碳化过程中可以采用递进式增加 CO2压力。
3.4 钢渣的粒径和超声处理对湿法碳化的影响
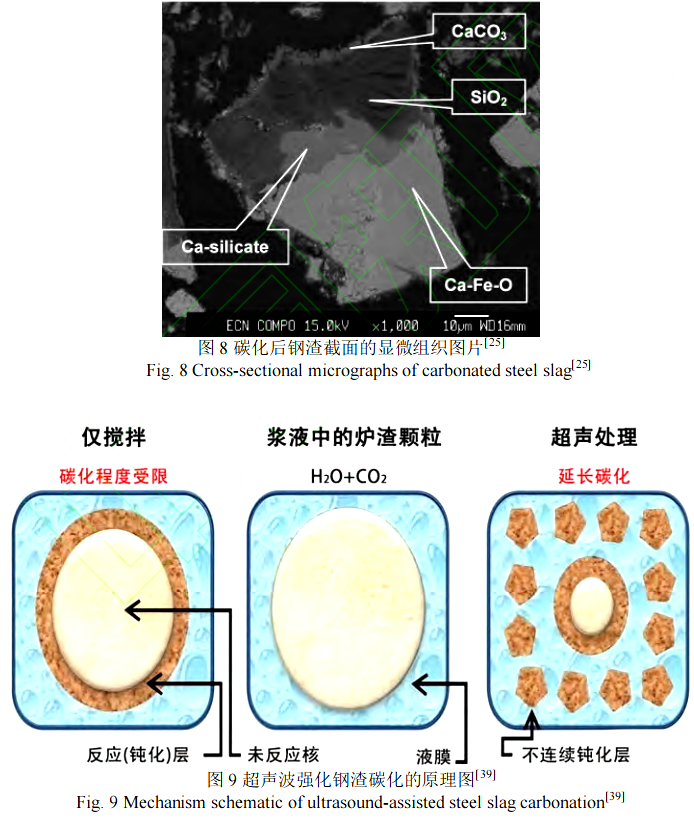
Huijgen 等人[25]研究发现在加水量(液固比)、温度、CO2压力等条件处于最优条件时,钙从钢渣颗粒中的浸出是碳化反应的限制性环节,即钙从钢渣内部向表面的扩散是限制性环节。对反应产物层形貌和显微结构进行分析发现,在硅酸钙碳化反应后形成贫钙的二氧化硅区和析出的碳酸钙颗粒包覆在未反应的硅酸钙表面(如图 8 所示),这严重阻碍了钙从未反应的硅酸钙相向钢渣颗粒表面的扩散传递。减小反应产物层厚度是最为行之有效的措施,有两条路径,其一是减小钢渣颗粒尺寸以达到缩短钙浸出过程的扩散距离,研究表明减少钢渣颗粒尺寸可以极大程度提高碳化速率和固碳量,当钢渣尺寸从小于 2 000 μm减小到小于 38 μm 时,钢渣中钙的碳化率从约 26%增加到 74%[25]。第二条路径则是破坏或去除产物层,利用超声波可以加快湿法碳化过程的速率并提高固碳量[39],其机理就是通过超声波去除阻碍传质的钝化层(析出的碳酸钙颗粒和残余二氧化硅)来实现增强碳化的目的,并且已经通过钢渣尺寸的变化得到证明,其原理路线如图 9 所示。在只有搅拌的碳化过程中,碳化颗粒的尺寸是增加的;而在使用超声波的条件下,碳化颗粒产物层被打碎,碳化颗粒尺寸减小,从而增强了钢渣的碳化,但是该过程需要对超声波参数进行优化,避免大的能量消耗。
4 结 语
1)钢渣的高温碳化过程主要的限制性环节是 CO2穿过产物层向钢渣内部未反应区域的扩散,提高温度可以增加 CO2 的扩散速率,最佳碳化温度仅仅低于稳定碳化和碳酸盐分解之间的转变温度,减小钢渣尺寸可以缩短 CO2 扩散路径,因此对高温干法碳化十分有利。
2)湿法碳化的主要限制环节是钢渣中钙从内部向钢渣表面的扩散,在对加水量(液固比)、温度、CO2 压力和搅拌速率等条件优化后,减小钢渣尺寸和利用超声波震荡能有效加快扩散。
3)由于钢渣从转炉出来后具有较高的温度,且单一的碳化方式都有其局限,可考虑将两种固碳方式结合使用,首先在高温钢渣冷却过程中利用钢渣余热进行高温干法碳化,并降低钢渣颗粒尺寸从而提高固碳量和钙的转化率;通过干法碳化固定一部分钙,减轻湿法碳化任务,有利于缩短湿法碳化时间,待钢渣高温碳化结束经球磨后再进行湿法碳化,结合尺寸优化和超声波的利用,实现钢渣最大程度的碳化;该过程充分利用了钢渣自身条件,能更有效发挥出钢渣固碳的优势,有利于固废资源和能量的高效分级利用。
[参考文献]
[1] 郭英楠. 大气二氧化碳浓度达历史顶点[J]. 生态经济, 2019, 35 (7): 5-8.
[2] 刘政阳, 李挺宇. 全球气候变暖趋势急剧加速[J]. 生态经济, 2019, 35 (9): 1-4.
[3] 韩敏, 俞金香.碳捕获与封存技术法律规制的现状及问题研究[J]. 兰州大学学报(社会科学版), 2015, 43(3): 95-101.
[4] BODOR M, SANTOS R M, GERVEN T V, et al. Recent developments and perspectives on the treatment of industrial wastes by mineral carbonation-a review[J]. Central European Journal of Engineering, 2013, 3(4): 566-584.
[5] LACKNER K S. A guide to CO2 sequestration[J]. Science, 2003, 300(5626): 1677-1678.
[6] SEIFRITZ W. CO2 disposal by means of silicates[J]. Nature, 1990, 345(6275): 486.
[7] XUE Yongjie, WU Shaopeng, HOU Haobo, et al. Experimental investigation of basic oxygen furnace slag used as aggregate in asphalt mixture[J]. Journal of Hazardous Materials, 2006, 138(2): 261-268.
[8] CHANG E E, CHEN C H, CHEN Y H, et al. Performance evaluation for carbonation of steel-making slags in a slurry reactor[J]. Journal of Hazardous Materials, 2011, 186(1): 558-564.
[9] WANG G, WANG Y H, GAO Z L. Use of steel slag as a granular material: Volume expansion prediction and usability criteria[J]. Journal of Hazardous Materials, 2010, 184(1/2/3): 555-560.
[10] BOBICKI E R, LIU Qingxia, XU Zhenghe, et al. Carbon capture and storage using alkaline industrial wastes[J]. Progress in Energy and Combustion Science, 2012, 38(2): 302-320.
[11] ELONEVA S, TEIR S, SALMINEN J, et al. Steel converter slag as a raw material for precipitation of pure calcium carbonate[J]. Industrial & Engineering Chemistry Research, 2008, 47(18): 7104-7111.
[12] ELONEVA S, TEIR S, REVITZER H, et al. Reduction of CO2 emissions from steel plants by using steelmaking slags for production of marketable calcium carbonate[J]. Steel Research International, 2009, 80(6): 415-421
[13] ELONEVA S, MANNISTO P, SAID A, et al. Ammonium salt-based steelmaking slag carbonation: Precipitation of CaCO3 and ammonia losses assessment[J]. Greenhouse Gases Science & Technology, 2011, 1(4):305-311.
[14] DIGIOVANNI C, HISSEINE O A, AWOLAYO A N. Carbon dioxide sequestration through steel slag carbonation: Review of mechanisms, process parameters, and cleaner upcycling pathways[J]. Journal of CO2 Utilization, 2024, 81.DOI:10.1016/j.jcou.2024.102736.
[15] 刘文昊, 陈庆彩, 徐腾飞. 双碳战略背景下的钢渣固碳技术研究进展[J]. 环境工程, 2024, 42(5): 172-182.
[16] 王爱国, 何懋灿, 莫立武,等. 碳化养护钢渣制备建筑材料的研究进展[J]. 材料导报, 2019, 33(9): 2939- 2948.
[17] TIAN Sicong,JIANG Jianguo,CHEN Xuejing, et al. Direct gas-solid carbonation kinetics of steel slag and the contribution to in situ sequestration of flue gas CO2 in steel-making plants[J]. ChemSusChem, 2013, 6(12): 2348-2355.
[18] GAO Zihe, ZHAO Qing, TAO Mengjie, et al. Recent research progress on the direct carbon capture of steel slag to prepare building materials[J]. Green and Smart Mining Engineering, 2024, 1(4): 387-395.
[19] MYERS C A, NAKAGAKI T, AKUTSU K. Quantification of the CO2 mineralization potential of ironmaking and steelmaking slags under direct gas-solid reactions in flue gas[J]. International Journal of Greenhouse Gas Control, 2019, 87: 100-111.
[20] BHATJA S K, PERLMUTTER D D. Effect of the product layer on the kinetics of the CO2-lime reaction[J]. AIChE Journal, 1983, 29(1): 79-86.
[21] REVATHY T D R, PALANIVELU K, RAMACHANDRAN A, et al. Direct mineral carbonation of steelmaking slag for CO2 sequestration at room temperature[J]. Environmental Science and Pollution Research, 2016, 23(8): 7349-7359.
[22] WANG JUNYA, ZHONG MI, WU PENGFEI, et al. A review of the application of steel slag in CO2 fixation[J]. ChemBioEng Reviews, 2021, 8(3): 189-199.
[23] COSTA G, BACIOCCHI R, POLETTINI A, et al. Current status and perspectives of accelerated carbonation processes on municipal waste combustion residues[J]. Environmental Monitoring and Assessment, 2007, 135(1/2/3): 55-75.
[24] THONEMANN N, ZACHAROPOULOS L, FROMME F, et al. Environmental impacts of carbon capture and utilization by mineral carbonation: a systematic literature review and meta life cycle assessment[J]. Journal of Cleaner Production, 2022, 332.DOI:10.1016/j.jclepro.2021.130067.
[25]HUIJGEN W J J,WITKAMP G J,COMANS R N J.Mineral CO2 sequestration by steel slag carbonation[J].Environmental science & technology, 2005, 39(24):9676-9682.
[26] KIM J, AZIMI G. The CO2 Sequestration by supercritical carbonation of electric arc furnace slag[J]. Journal of CO2 Utilization, 2021, 52.DOI:10.1016/j.jcou.2021.101667.
[27] REDDY E P,SMIRNIOTIS P G .High-temperature sorbents for CO2 made of alkali metals doped on CaO supports[J].Journal of Physical Chemistry B, 2004, 108(23):7794-7800.
[28] BLARNEY J, ANTHONY E J, WANG J, et al. The calcium looping cycle for large-scale CO2 capture[J]. Progress in Energy and Combustion Science, 2010, 36(2): 260-279.
[29] MANOVIC V, ANTHONY E J. Lime-based sorbents for high-temperature CO2 capture—a review of sorbent modification methods[J]. International Journal of Environmental Research and Public Health, 2010, 7(8): 3129-3140.
[30] SANTOS R M, LING D, SARVARAMINI A, et al. Stabilization of basic oxygen furnace slag by hot-stage carbonation treatment[J]. Chemical Engineering Journal, 2012, 203(1): 239-250.
[31] 涂茂霞, 雷泽, 吕晓芳, 等. 水淬钢渣碳酸化固定 CO2[J]. 环境工程学报, 2015, 9(9): 4514-4518.
[32] 储健. 转炉钢渣碳化砖的试验研究初探[J]. 粉煤灰, 1998(2): 26-28.
[33] 吴昊泽, 张林菊, 叶正茂, 等. 水分对钢渣碳化的影响[J]. 济南大学学报(自然科学版), 2009, 23(3): 221- 224.
[34] 张丰, 莫立武, 邓敏. 碳化 MgO-CaO-粉煤灰-水泥四元组分制备砂浆的强度和微观结构[J]. 硅酸盐学报, 2015, 43(8): 1032-1039.
[35] 吴昊泽, 徐东宇, 梁晓杰. CO2压力对碳化养护钢渣制备建筑材料的影响[J]. 商品混凝土, 2020(6): 36-38.
[36] KURUSTA T, MUCSI G, KUMAR S, et al. Carbon-dioxide sequestration by mechanical activation of Linz Donawitz steel slag; the effect of water on CO2 capture[J]. Fuel, 2023, 352.DOI: 10.1016/j.fuel.2023.128951.
[37] WANG Shuping, WANG Mingda, LIU Fang, et al. A Review on the Carbonation of Steel Slag: Properties, Mechanism, and Application[J]. Materials, 2024, 17(9): 2066.DOI: 10.3390/ma17092066
[38] CHEN Zhaohou,CANG Zhizhi,YANG Fengmin,et al.Carbonation of steelmaking slag presents an opportunity for carbon neutral: A review[J]. Journal of CO2 Utilization, 2021, 54. DOI:10.1016/j.jcou.2021.101738.
[39] SANTOS R M, FRANÇOIS D, MERTENS G, et al. Ultrasound-intensified mineral carbonation[J]. Applied Thermal Engineering, 2013, 57(1/2): 154-163.
